化学において出てくる反応の中で、ひときわ大きな存在感を締めるのが、炎色反応です。
この炎色反応は、学校の定期テストはもちろん、センター試験や二次試験まで広く出題される可能性があります。
そこで、この記事では炎色反応の覚え方から、原理、そして実際にどのような使われ方をしているのかについて書いていきたいと思います!
ぜひ化学で高得点が取れるように頑張ってみてください!
目次 (クリックでジャンプ)
炎色反応とは?

そもそも炎色反応とは一体なんでしょうか?
教科書で説明されている内容を見てみると、
炎色反応とは、アルカリ金属の化合物を炎の中に入れると、それぞれの元素に特有の光がみられる反応
とされています。
そもそもアルカリ金属って何?って話ですよね…
アルカリ金属とは、元素の周期表の1族元素のうち、水素を除くリチウム Li からフランジウム Frまでの6元素です。(覚えなくていいです。)
これらの元素は、ぱっと見ではわかりづらいんですね。だから、どうにかしてこれらを区別したかったんです。
そんな時に炎の中に入れて見たら、偶然にも(?) それぞれの色が違っていたことを発見しました。それ以降、元素の区別をする際に「炎の中に入れたらええやん!」ということになったのが炎色反応の始まりです。
幸い、アルカリ金属の他にもアルカリ土類金属やどうなども炎色反応を示したので、今では広く一般的な金属の判別法として知られています。
金属と色の関係
では、なんの金属が何色かを見ていきたいと思います。写真とかはWikipediaさんにあるのでそちらで見てもらえればと思います。
| リチウム | ナトリウム | カリウム | 銅 | バリウム | カルシウム | ストロンチウム |
| 赤 | 黄 | 赤紫 | 青緑 | 黄緑 | 橙 | 紅 |
他にも、様々な金属で炎色反応が見られるのですが、高校生までに覚えておきたい金属と炎の色の関係はこれくらいです。
ゴロ合わせを使った覚え方
さて、では上の表を全て覚えてください!と言われても、いきなりは無理ですよね?
そこで、ここでゴロ合わせを使った炎色反応の覚え方を紹介したいと思います。
リアカー無き K村 動力 馬力 借りんとするもくれない
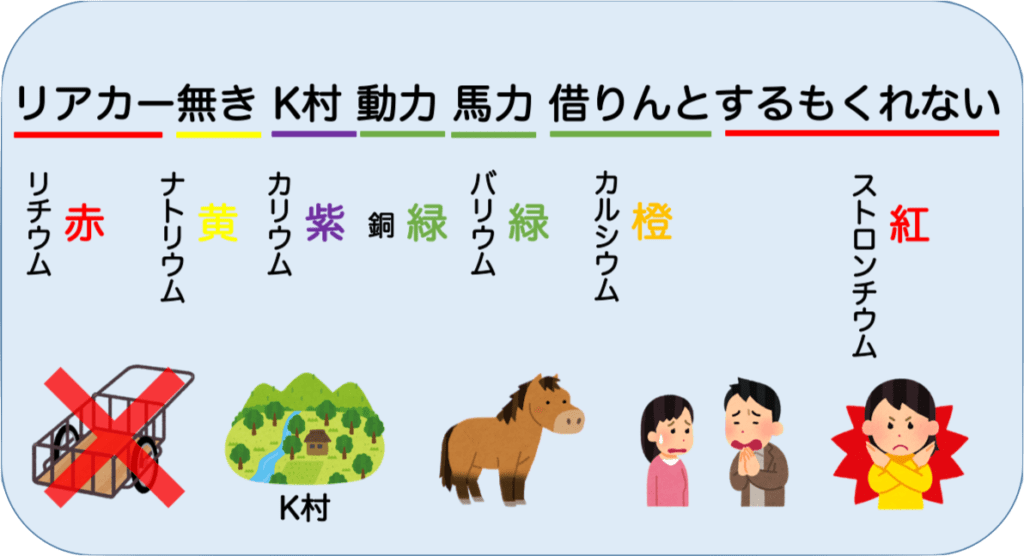
リ(Li) アカー(赤) 無(Na) き(黄) K村(紫) 動(Cu)力(緑) 馬(Ba)力(緑) 借(Ca)りんと(橙)する(Sr)もくれない(紅)
この覚え方は問題の出題者も知っているので、炎色反応の問題の99%はここから出ると言ってもいいくらいです。
なので、10回でも100回でも暗唱して、完璧に覚えるようにしてください!
少し脱線しますが、たまに問題で「銅の炎色反応を使って塩素元素の確認」をするというものがあります。
これは、銅の炎色反応だけでは目に見えにくいので、BuCl2によって反応を目に見えやすくするためで、バイルシュタインテストと呼ばれています。
この方法によって塩素の存在を確認する問題がたまーに出るので、頭の片隅にでもおいておくといいかもしれません。
炎色反応の原理
では、ここからは炎色反応の原理について書いていきたいと思います。
ざっくりと書いていくので、細かいことが気になる人は自分で調べてみてください。
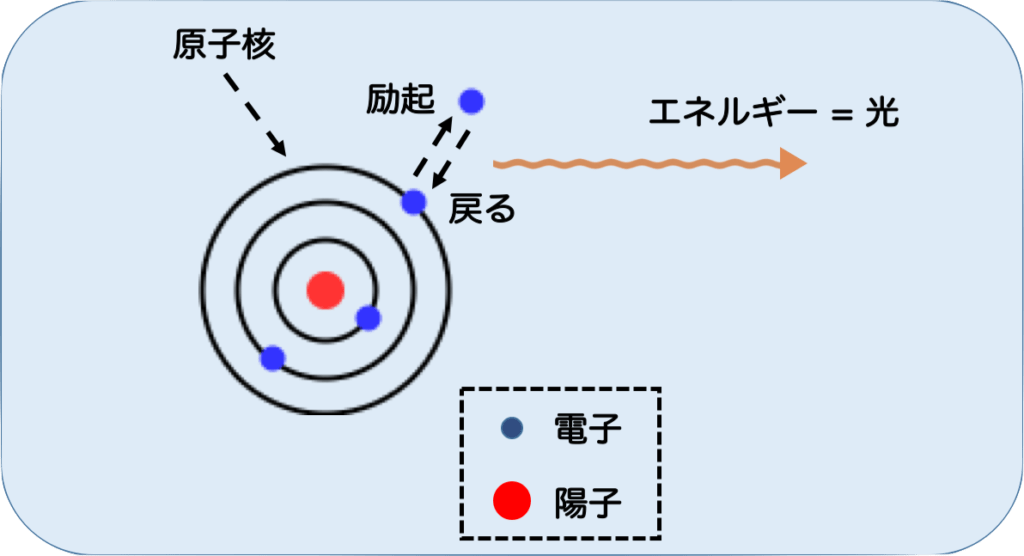
まず、金属を炎の中に入れると、一部が気化します。そして、その金属原子中の電子が炎の熱エネルギーによって高いエネルギー状態になります。これを、励起状態と言います。
この状態は不安定なので、すぐに低い状態に移ろうとします。この時、元に戻る際には余分なエネルギーを捨てなければなりません。
そこで、エネルギーを光として放出し、元の状態に戻ります。この時にでた光が、炎色反応として見える光になります。
なぜ金属によって色が違うかは、励起→放出時のエネルギーがどれだけあるかによって決まります。
詳しくは、「エネルギーギャップ」とかの言葉で検索してみてください!
炎色反応の実験について
炎色反応の実験について軽く触れておきたいと思います。実験は、概ね以下の図のように行われます。
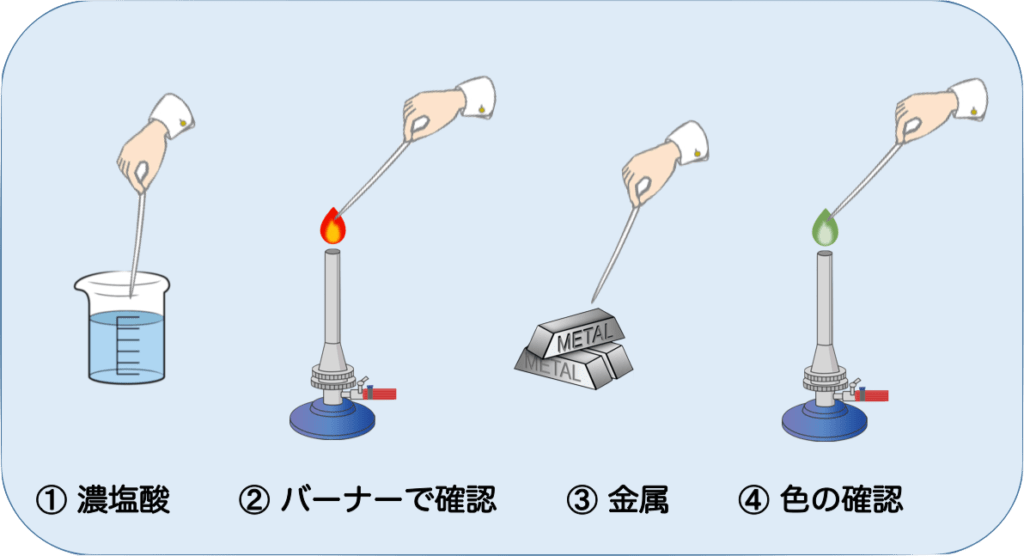
- 白金線の先端を濃塩酸に浸す
- ガスバーナーで色がつかない炎を確認する
- 白金線の先端に金属をつける
- ガスバーナーの炎で加熱し、色を見る
注意したいのは、前回の金属が残らないように①と②を、色が消えるまで繰り返すことです。
これをしないと、色がわかりにくくなったりするので注意しておいてください。
炎色反応の使われ方・見えるところ
1. 物質の判別

当たり前ですが、炎色反応は物質を判別する際に使われます。
その理由として、実験が簡単であることが挙げられます。ガスバーナーを用意し、単純に熱するだけなので、どの判別法よりも簡単なのです。
また、化合物においてもアルカリ金属が混ざっていれば反応することも理由の一つです。
これらの特徴から、まず何かわからない時にざっくりと判別したい時などには炎色反応をしてみるというのが一般的です。
2. 花火

有名な炎色反応の使われ方として、花火があります。
花火の赤色では一般的に、ストロンチウムやカルシウムの化合物、黄色はナトリウム化合物、緑はバリウム化合物、そして青色は銅の化合物が用いられています。
また、こうした色を重ね合わせて様々な色が作られています。
余談ですが、花火を見に行った時に、「あ、炎色反応だ!」と思っても決して口に出してはいけません。「何言ってんの?」と思われる確率が50%、「当たり前のこというなよ…」思われる確率が50%で、どちらにしてもいいことはありません。
3. 鉄鍋
コンロで鉄の鍋などを「ガタガタッ」とやると、たまに緑色の炎が上がる時がありますよね?これは、鍋の金属の炎色反応と言えます。
また、味噌汁などをこぼしたりすると、炎が黄色になったりしますよね?これも、味噌汁の中のナトリウムの色が出たりします。
このように、身の回りにも炎色反応が見られたりします。他にもないかどうか、探して見ましょう。
最後に
炎色反応の覚え方や原理などについて見てきました。理解できたでしょうか?
炎色反応は、見た目的にもインパクトがあり、問題としても良く出題されたりします。特に、実験中に物質を確認したりする問題は、頻出です。
なので、是非ともあのゴロは覚えておきたいですね?まだ言えますか?
「リアカー無き K村 動力 馬力 借りんとするもくれない」
でしたね?
是非覚えて、パッと思い出せるようにして見てください!